Zellbewegung ohne Motoren
Physiker stellen das klassische Dogma infrage, wonach der molekulare Motor Myosin für die Fortbewegung von Säugetierzellen notwendig ist.
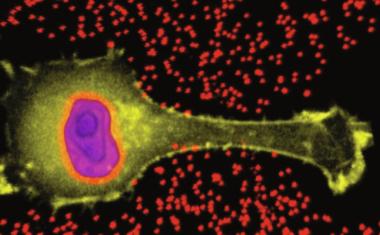
Die Bewegung von Zellen im menschlichen Körper – die Zellmigration – ist von zentraler Bedeutung für Immunzellen. Diese müssen sich rasch und flexibel in unterschiedlichen Umgebungen bewegen, um ihre Funktion als Teil unseres Immunsystems zu erfüllen. So zirkulieren weiße Blutzellen mit dem Blutstrom durch den Körper. Bei Bedarf verlassen sie die Blutgefäße und migrieren selbstständig durch Gewebe an die Stellen, an denen sie gebraucht werden, um beispielsweise Viren zu bekämpfen. Zellmigration kann jedoch auch schädlich sein: Krebszellen können durch den Körper migrieren, in anderes Gewebe eindringen und Metastasen bilden. Ein Verständnis der Zellmigration ist somit zentral für die Entwicklung neuer Medikamente und für Strategien zur Behandlung von Krankheiten.

Unter den verschiedenen Zelltypen im Körper von Menschen und Säugetieren zeichnen sich die Zellen des Immunsystems durch ihre schnelle Bewegung aus. Wesentliche Bestandteile dieser Zellen sind fadenartige Proteinstrukturen, die Aktinfilamente, welche ein Netzwerk entlang der Innenseite der Zellmembran, die Oberfläche der Zelle, bilden. Dieses Netzwerk ist dynamisch und wird ständig umgestaltet, indem sich Aktinbausteine an einem Ende eines Filaments anlagern oder abgespaltet werden.
Im klassischen Modell ist für die Entstehung der Zellbewegung der molekulare Motor Myosin notwendig. Diese Motoren verschieben Filamente gegeneinander und ziehen so das Netzwerk im hinteren Teil der Zelle zusammen, wodurch ein Fluss der Aktinfilamente von vorne nach hinten entsteht. Dieser Fluss ermöglicht der Zelle, sich nach vorne zu bewegen. Experimente, in denen die Aktivität von Myosin biochemisch unterdrückt wurde, haben jedoch gezeigt, dass sich Zellen auch unabhängig von diesem molekularen Motor fortbewegen können.
Jetzt haben Physiker der Universitäten Bayreuth und Grenoble einen Mechanismus entdeckt, mit denen Zellen diese myosinunabhängige Fortbewegung gelingt. Hierfür haben die Forscher ein Modell entwickelt, das zeigt, dass die Anlagerung und der Abbau der Aktinbausteine an den Filamenten für die Zellbewegung ausreicht – vorausgesetzt, dieser Prozess geht schnell genug. Oberhalb dieses kritischen Geschwindigkeitswerts verändert sich die Verteilung der Aktinfilamente innerhalb der ursprünglich kugelförmigen Zelle, wodurch sich eine Vorder- und Rückseite ausbildet, die sich durch unterschiedliche Spannungen auszeichnen. Wo vorn in der Zelle Filamente weniger dicht unter der Membran liegen, entstehen größere Spannungen als im hinteren Teil der Zelle mit mehr Filamenten auf gleicher Oberfläche.
Dieser Unterschied sorgt dafür, dass weitere Aktinfilamente von vorne nach hinten fließen, wodurch ein sich selbst erhaltender Kreislauf entsteht. Letztendlich entsteht also auch ohne molekulare Motoren ein Aktinfluss, der die Zelle bewegt.
U. Bayreuth / RK