Nach Molekülen in einer Zelle suchen
Nanoauflösende chemische und topographische Bildgebung an Einzelzellen.
Wie verteilt sich eine chemische Substanz in einer Zelle? Wissenschaftler aus China haben jetzt ein hochauflösendes Analyseinstrument zur direkten Kartierung von Substanzen in der Zelle entwickelt. Sie zeigen, wie durch eine Verknüpfung von Massenspektrometrie und biologischer Bildgebung die Verteilung des Antiseptikums Proflavin um die Zellorganellen herum genau gemessen werden kann.
Um Proteine, aber auch eingedrungene Moleküle in biologischen Zellen extrem genau, also mit molekularer Auflösung, lokalisieren zu können, werden seit Langem optische Methoden wie die ultrahochauflösenden STED- und PALM-Mikroskopietechniken eingesetzt. Allerdings arbeiten diese nur indirekt: Das Zielmolekül muss vorher mit einem Fluoreszenzfarbstoff markiert werden, dessen Fluoreszenz dann sichtbar ist.
Eine direkte Methode ist die Massenspektrometrie. Moleküle werden von einer Oberfläche abgelöst, in einem Laserstrahl ionisiert und dann anhand ihrer Masse aufgeschlüsselt. Allerdings ist die Massenspektrometrie selbst kein bildgebendes Verfahren. Verbindet man jedoch Massenspektrometrie mit hochauflösender Bildgebung, dann stößt man rasch an beugungsbedingte Auflösungsgrenzen. Außerdem verursachen biologische Zellen mit ihren rauen Oberflächen Artefakte, die eine höhere Auflösung verhindern. Dem haben sich jetzt Wei Hang und seine Kollegen an der Universität Xiamen in China angenommen. Sie verknüpften ein Flugzeit-Massenspektrometer mit einer bildgebenden Methode, die Desorption und Ionisierung so integriert, dass sowohl der Oberflächenbeschaffenheit von biologischen Zellen als auch der erforderlichen hohen Bildauflösung Rechnung getragen wird.
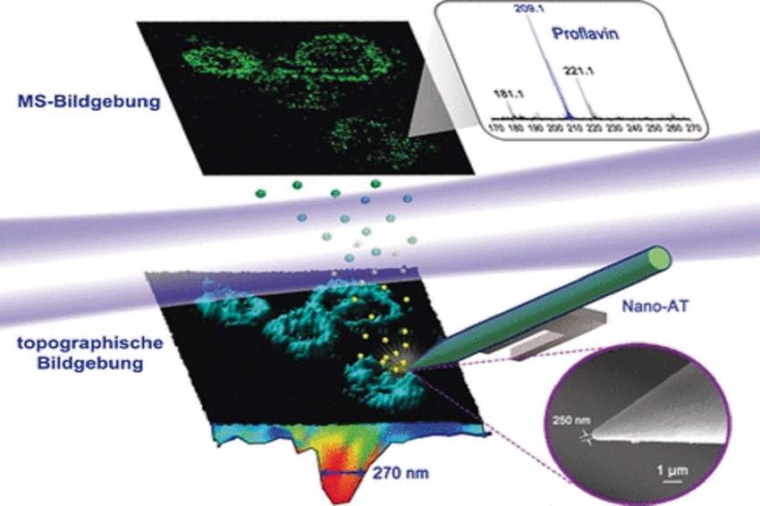
Mit diesem Aufbau, einem „Near-field desorption postionization time-of-flight mass spectrometer“ (NDPI-TOFMS) identifizierten sie direkt Moleküle in HELA-Zellen – einer seit Jahrzehnten etablierten menschlichen Zelllinie in Laboratorien – und erstellten eine Karte dieser Moleküle in der Zelle. Hierfür wurden die Zellen mit einem hochpräzisen Laser abgetastet, wobei der Laser jeweils Krater von Bruchteilen von Mikrometern Durchmesser bohrte. Die dadurch abgelösten Moleküle wurden in einem zweiten Laserstrahl ionisiert und dann im Massenspektrometer analysiert.
Der Vorteil der Methode ist, so die Forscher, dass bereits im Moment der Probennahme ein Bild der Zellen erstellt wird. Damit sei eine gleichzeitig chemische und topographische Bildgebung in einer Einzelzelle möglich. Tatsächlich bildeten die 3D-rekonstruierten Bilder das Proflavin-Signal – das chemische Antiseptikum Proflavin wurde den Zellen zuvor von außen zugefügt – genau da ab, wo es erwartet wurde: im Zytoplasma und um die Zellorganellen herum. Mit den dreidimensionalen Daten wurde die unebene Oberfläche einberechnet.
Anders als die bekannten Techniken der massenspektrometrischen Bildgebung biete diese Hybrid-Technik, die Rastermikroskopie und Massenspektrometrie vereinigt, „eine unverzerrte hochauflösende chemische Kartierung von unregelmäßigen Oberflächen“, sagt Hang. Das Instrument ist auch verhältnismäßig kompakt, sodass man es laut Hang leicht in verschiedene bildgebende Verfahren, besonders für biologische Proben, integrieren kann.
Es gibt aber noch Verbesserungspotenzial: Eine chemische Kartierung im Submikrometermaßstab war zwar möglich, aber die Wissenschaftler möchten den Maßstab noch weiter verkleinern. Auch muss die Zellaufbereitung optimiert werden, so die Autoren. Dann aber könnte man leicht hochauflösende Karte der Verteilung von chemischen Substanzen in biologischen Zellen direkt und ohne vorherige Markierung erstellen.
GdCh / RK
Weitere Infos
- Originalveröffentlichung
Z. Yin et al.: Chemical and Topographical Single‐Cell Imaging by Near‐Field Desorption Mass Spectrometry, Ang. Ch., online 2. Januar 2019; DOI: 10.1002/ange.201813744 - Key Laboratory of Spectrochemical Analysis and Instrumentation, College of Chemistry and Chemical Engineering, Xiamen University, Xiamen, China